
最近几年是抗癌新药的井喷期,从2014到2018,FDA一共批准了57个抗癌新药上市,覆盖23个癌种,89个适应症。遗憾的是,其中没有一个是中国研发的。
现在,这个遗憾终于了却。
就在今天,泽布替尼(zanubrutinib)被美国FDA批准上市,用于治疗复发难治性的套细胞淋巴瘤(MCL)。
这对于中国制药界是个标志性事件。历史上第一个完全由中国药企自主研发并在FDA获批上市的抗癌新药,就此诞生!
泽布替尼由总部位于北京的百济神州公司的中国科学家团队研发,从实验室中立项到获批,前后历时超过7年。
中国抗癌新药出海是个重要事件
以往,中国也向海外出口药品,但基本都是原料药或仿制药,原创性不高,利润也不高。真正让企业和国家获利丰厚的,还得是原创新药。比如瑞士两大创新药企,诺华和罗氏,都是国宝级的存在。
客观地讲,中国药企和欧美的整体实力差距是巨大的,尤其是科研上的差距。中国很多药企无论是对新药开发的资金投入还是相关人才招募,都是很匮乏的。在过去几十年,一个欧美顶尖药厂每年投入研发的资金,会超过中国所有药企的总和!
这直接导致中国药厂虽然不少,但能研发高质量新药的很少,在欧美市场有竞争力的几乎不存在。有些国产抗癌药在国内卖得很好,但由于竞争力等因素,并没有在海外寻求上市。
近年来中国上市的抗癌新药,也绝大多数都是跨国药厂的进口产品。比如,2017年,中国一口气批准了5个抗癌新药上市,包括奥希替尼(肺癌),培唑帕尼(肾癌),阿法替尼(肺癌),维莫非尼(黑色素瘤),和瑞戈非尼(肠癌和肝癌)。无一例外,全都来自国外药企。
最近十年,情况开始发生改变。百济神州,恒瑞医药等公司开始重金投入研发,仅仅百济在2018年研发就投入了超过40亿,非常惊人。持续的投入多年后,最近终于开始收获。
正因为如此,泽布替尼在美国上市,是一个让人欣喜的里程碑。
百济神州的研发策略
本次获得美国FDA批准的泽布替尼,同样是一款BTK抑制剂。有趣的是,BTK最初并非是百济神州的首选靶点。
2010年,在百济神州成立之初,一切都还刚刚起步。当时,许多新锐公司建立于特定的生物技术平台之上,利用这些平台技术开发新型产品。而百济神州在这一方面,则显得更为“传统”。秉持“在中国做创新药”的理念,百济神州的初创团队在最初选择了务实与前瞻并举的研发策略——短期之内,先做一些成药可能性高、周期短的项目,解决生存问题;长期来看,要做跟别人不一样的新药,做到真正创新。
但这并不是简单地做“me-too”或“me-better”。百济神州向我们透露,当时对靶点的选择有两大原则。首先,这个靶点在概念验证(proof of concept)上,已经有了明确的数据支持,但市场上不一定已经有了药物;其次,科学家们要对靶点及化合物有充分了解,知道哪些方面可以做出差异化,具备做出“best-in-class”的潜质。
基于这两大原则,百济神州快速启动了多个项目,并很快收获了积极的成果。其中,一款叫做BGB-283(lifirafenib)的RAF抑制剂能够创新地抑制RAF单聚体和双聚体,另一款名为BGB-290(pamiparib)的小分子也能够有效抑制PARP1与PARP2。这两款创新分子的开发,为当时尚处于襁褓中的百济神州带来了关键的合作资金。这也让研发人员能够站稳脚步,将目光投向下一个靶点。
而他们的选择,就是BTK。
绝大多数患者病情控制超过两年半
BTK蛋白是个对B细胞发挥功能非常重要的蛋白,是B细胞生长的核心开关,控制着细胞的扩增、分化,凋亡以及迁移。
恶性B细胞为了保持快速生长,很聪明地绑架了BTK蛋白,导致它持续激活,促进着癌细胞的生长和扩散。
了解了这个,科学家自然而然就想到:如果开发针对BTK的靶向药物,从而抑制它的活性,是否也能顺利控制恶性B细胞的生长,从而顺利阻击相关癌症呢?
答案是肯定的!
全球第一个上市的BTK抑制剂叫伊布替尼,2013年在美国上市,2017年在中国上市。临床试验中,它表现非常优异,比如,用于慢淋白血病的时候,完爆了化疗,让超过98%的患者都存活了超过两年。
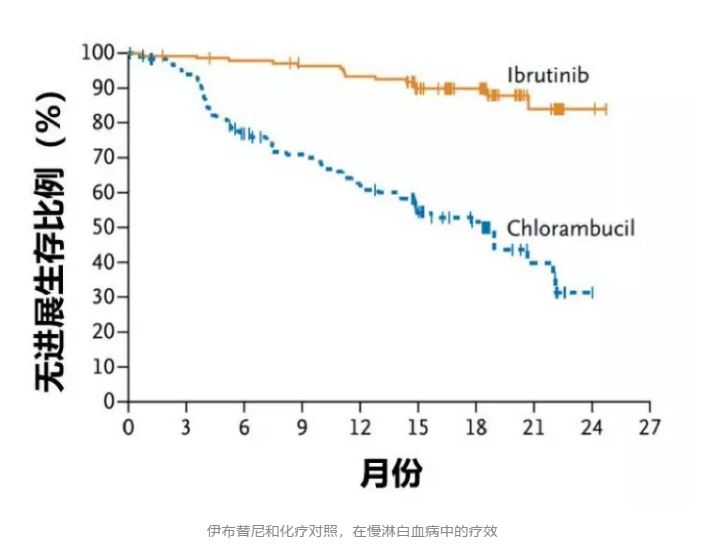
▲伊布替尼和化疗对照,在慢淋白血病中的疗效
而泽布替尼,是新一代BTK抑制剂的代表。第一代BTK抑制剂效果虽然好,但在疗效,吸收性和安全性上,都还有提高的空间。科学家希望通过进一步改造药物结构,增强疗效,同时降低副作用。科学家希望通过进一步改造药物结构,增强疗效,同时降低副作用。科学家希望通过进一步改造药物结构,增强疗效,同时降低副作用。科学家希望通过进一步改造药物结构,增强疗效,同时降低副作用。
在这个背景下,中国的科学家开发出了泽布替尼。
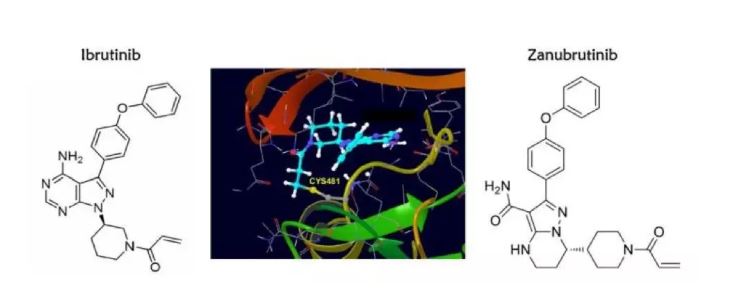
▲临床试验中,泽布替尼表现非常优异。
比如,在一项中国患者的2期关键研究中,结果显示,复发难治性的套细胞淋巴瘤患者,使用泽布替尼后的总缓解率达到84%,其中78%都达到了完全缓解。正是基于这项研究,FDA在今年初授予了泽布替尼“突破性疗法认定”,并受理了新药上市申请,这也是FDA历史上,第一次用主要基于中国的临床研究授予突破性疗法认定、受理上市申请。
这项研究,是由我非常尊重的临床研究者,北京大学肿瘤医院淋巴瘤科主任朱军教授团队牵头主导的。他们推动并见证了中国抗癌新药走向世界。
在慢淋白血病临床试验中,泽布替尼表现依然优秀,客观缓解率高达94%,下面这个无进展生存曲线是非常惊艳的。可以看出,绝大多数患者的疾病都被成功控制了超过2年半。
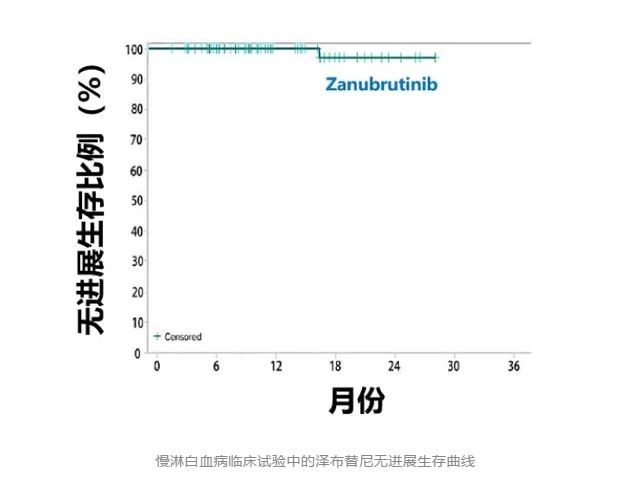
慢淋白血病临床试验中的泽布替尼无进展生存曲线
值得一提的是,泽布替尼的临床研究是国际性的,招募的患者来自20多个国家,这也是它能走向国际、得到FDA认可的因素之一。这些经验,都给未来中国其它抗癌新药出海提供了指导方向。两代替尼头对头研究已启动
泽布替尼去年就已经提交了中国上市申请。随着美国FDA的批准,相信在中国上市指日可待,期待本土研发的好药早日使国内的患者也受益。
大家可能会问,泽布替尼和伊布替尼如果都上市,到底怎么选?
这个目前没有结论。
泽布替尼虽然展现了优秀的数据,但伊布替尼已经上市多年,医生和患者都更熟悉。要证明泽布替尼是目前最好的BTK抑制剂(所谓best-in-class),从而在国际市场上有竞争力,就必须在同一个试验中战胜伊布替尼。
到底哪个更好,应该很快就会有眉目了。因为百济已经开展了两项泽布替尼与伊布替尼的全球头对头三期临床研究,分别针对华氏巨球蛋白血症,和复发/难治型慢性淋巴细胞白血病。
这种全球头对头研究很少有中国企业做,因为它消耗时间长,招募患者多,因此耗资巨大(超过数十亿元),风险是巨大的。从这个举动也可以看出百济对这个产品的信心和进军国际市场的野心。
按照试验设计,我们最近就应该会看到华氏巨球蛋白血症中的初步数据,非常值得期待。
一款药物的研发背后,是一整个团队的努力。百济神州充分发挥了作为一家创新生物技术的公司的优势,以极高的效率进行了决策沟通,快速推进着项目的前进。泽布替尼从立项到首例患者给药仅花了2年出头的时间,也充分证明了这支研发团队的专业与高效。
这是属于中国医药人的荣光!
编辑:沈湫莎
责任编辑:任荃
来源:菠萝因子、药明康德、财新网





