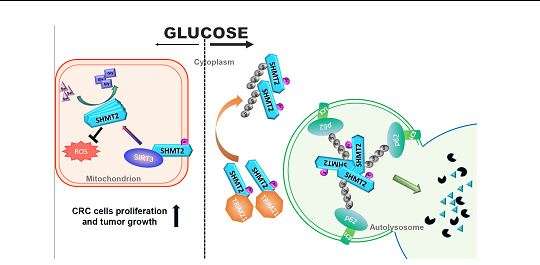
▲模式图(低葡萄糖促进SIRT3去乙酰化SHMT2,帮助提供细胞快速增殖需要的氨基酸;高葡萄糖导致高度乙酰化的SHMT2,进入溶酶体降解,抑制细胞快速增殖)
消化道肿瘤日益高发,令人闻之色变。近日,复旦大学生命科学学院余巍研究员与上海交通大学医学院附属新华医院崔龙教授课题组合作发现长寿基因SIRT3调控结直肠癌发生的新机制,为开发治疗结直肠癌的靶向药物提供了坚实的理论基础。昨天,相关研究成果在线发表在《自然·通讯》上。
结直肠癌是全世界最常见的一种消化道恶性肿瘤。随着国民生活水平提高和生活方式的转变,结直肠癌的发病率和死亡率正呈现逐年上升的态势,中国成为全球结直肠癌每年新发病例最多的国家。
目前,治疗结直肠癌主要依靠手术切除肿瘤结合放、化疗辅助等手段。从结直肠癌的致病机制以及影响疾病进程的遗传、表观遗传、代谢等因素出发,寻求新的诊断方法、药物靶点和预后干预手段十分必要。
复旦大学余巍课题组长期从事去乙酰化酶sirtuins家族调控衰老以及肿瘤代谢相关疾病的分子机制研究。继2017年在《美国科学院院报》上发表关于SIRT1响应氧化应激调控酪氨酸tRNA合成酶的工作后,余巍研究团队此次又揭示了sirtuins家族另一重要成员SIRT3调节肿瘤代谢的作用机制。
研究人员发现,线粒体主要去乙酰化酶SIRT3在葡萄糖饥饿的情况下,能直接结合一碳单位代谢通路中一个关键代谢酶——丝氨酸羟甲基转移酶2(SHMT2),并能去除SHMT2 K95的乙酰化修饰,稳定SHMT2的细胞内表达以及维持SHMT2的高活性。SHMT2主要负责细胞内丝氨酸和甘氨酸的相互转换,高活性的SHMT2能帮助细胞抵抗线粒体的活性氧压力,并保证细胞内生物大分子的供应,从而满足癌细胞快速增殖的需要。
研究人员在结直肠癌病人样本中发现,SIRT3和SHMT2协同高表达,相应地SHMT2 K95的乙酰化程度低。高表达SIRT3或SHMT2的结直肠癌病人手术后总存活率低,预后差。对SHMT2 K95的乙酰化修饰促进了E3连接酶TRIM21的结合,并导致乙酰化的SHMT2通过K63多聚泛素依赖的大自噬途径降解。这种修饰也削弱了结直肠癌细胞的增殖速率和成瘤能力。在诱导的小鼠肠炎模型中,Sirt3基因的缺失显著降低小鼠小肠的肿瘤大小和数量。免疫组化染色表明Sirt3 敲除小鼠的肿瘤细胞中SHMT2的表达量明显减少。
本研究还对SHMT2突变体进行了结构解析,发现SHMT2 K95突变成R/Q则破坏了SHMT2完整的功能性四聚体结构,从而降低了其对底物丝氨酸的亲和,降低酶的活性。此研究揭示了SIRT3-SHMT2调控轴在结直肠癌发生中发挥的作用,为开发靶向SIRT3-SHMT2调控轴治疗结直肠癌的靶向药物提供了坚实的理论基础。
复旦大学为该工作的第一完成单位。余巍课题组博士生魏珍和崔龙课题组博士生宋经略为该文共同第一作者。复旦大学余巍研究员、上海交通大学医学院附属新华医院崔龙教授、刘辰莹副研究员为共同通讯作者。复旦大学生命科学学院李继喜教授课题组对SHMT2突变体晶体结构提供解析,是本研究的共同作者。该研究得到了国家自然科学基金衰老重大研究计划、科技部重点研发计划和上海市教委“东方学者”等项目的资助。
作者:唐闻佳
编辑:顾军
责任编辑:张鹏
*文汇独家稿件,转载请注明出处。





