
近日,复旦大学基础医学院黄志力课题组与日本北海道大学本間Sato、榎木亮介团队合作,揭示了次昼夜节律的产生位点和神经网络机制,或可为开发生物节律异常和睡眠障碍的新疗法提供新思路。昨天,相关研究成果以《下丘脑室旁核和室旁下核钙信号的次昼夜生物节律》为题,在线发表于《美国科学院院刊》。

▲论文
控制昼夜节律关键基因的发现曾获2017年诺贝尔生理学或医学奖。说到生命体的昼夜节律或许还有些陌生,但说起它的另一个名称——“生物钟”,很多人都知道。由于不停的自转和围绕太阳公转,地球上的昼夜交替很有规律。为了适应地球的这种“节奏”,地球上的生命纷纷进化出了“生物钟”来控制自身系统的生理功能与之同步。
生物节律在动植物中广泛存在,最常见的是周期为24小时的昼夜节律,人类的睡眠-觉醒周期符合典型的生物节律。然而,哺乳动物的某些行为或功能还表现出周期短于24小时的次昼夜节律,如人类夜间的快动眼-非快动眼睡眠循环、下丘脑内激素分泌和体温调节等。由于次昼夜节律和昼夜节律经常伴随在一起,使次昼夜节律的研究具有难度。因此,揭示次昼夜节律的发生机制是重要的科学问题。
为探索次昼夜节律的发生机制,研究人员在新生4-6天小鼠的脑切片上表达钙离子指示剂GCaMP6s蛋白,该蛋白可以被激发产生荧光并随细胞内钙离子的动态变化而发生强度变化,钙信号的强弱反映神经元的活动度。利用实时荧光成像技术(Time-lapse imaging)连续一周以上监测离体脑片中神经元钙离子浓度的变化,发现在下丘脑室旁核(PVN)、室旁下核(SPZ)区域和一部分视交叉上核(SCN)区域,存在周期为0.5-4小时的次昼夜节律。
这种次昼夜节律从SPZ-PVN区域产生,次昼夜节律信号可以反馈到昼夜节律中枢SCN。
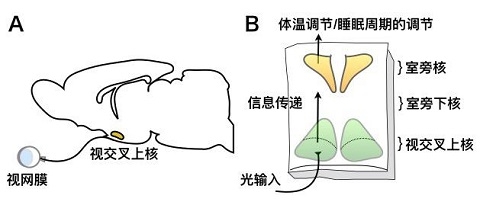
▲视交叉上核-室旁核-室旁下核的信息传递
通过药理学手段,进一步发现谷氨酸能系统参与了次昼夜节律的形成,钠离子通道阻断剂TTX敏感的神经网络参与次昼夜钙节律的同步化。
本研究首次发现了下丘脑室旁核和室旁下核存在次昼夜生物节律,揭示了次昼夜节律的产生位点和神经网络机制。研究结果对理解动物睡眠周期、体温调节和激素分泌等行为或功能的次昼夜节律具有重要启示,可能为开发生物节律异常和睡眠障碍的新疗法提供新思路。
据悉,复旦大学博士生吴瑜珥和北海道大学榎木亮介副教授为本文的共同第一作者,复旦大学教授黄志力和北海道大学榎木亮介副教授为本文的共同通讯作者,复旦大学为第一作者单位。该研究得到了国家自然科学基金重点项目等基金的资助。
文:李晨琰
编辑:沈湫莎
责编:顾军
*文汇独家稿件,转载请注明出处。





